(서울=NSP통신 박천숙 기자) = 식품의약품안전처(처장 정승)는 국내 제약사가 제조한 원료의약품을 EU에 수출할 때마다 제출해야 하는 ‘원료의약품 제조 및 품질관리 기준(GMP) 서면확인서’의 제출을 면제받기 위해 ‘GMP 면제국가 등재 신청서’를 지난 5일 EU에 제출했다고 8일 밝혔다.
국내 제약사가 2013년 7월부터 EU에 원료의약품을 수출하기 위해서는 식약처가 발행한 ’GMP 서면확인서‘를 반드시 제출하고 있으나 EU가 우리나라의 원료의약품 GMP 관리 수준이 EU와 동등하다고 인정하면 ‘GMP 서면확인서’ 제출이 면제된다.
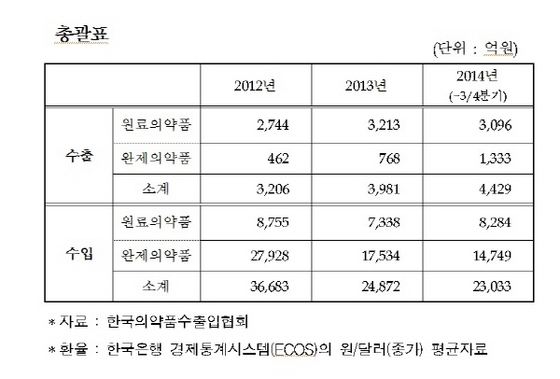
참고로 EU에 대한 의약품 수출 규모는 3981억원(2013년 기준)이다. 이중 81%인 3213억원은 원료의약품 수출에 의한 것.
이번에 식약처가 제출한 GMP 면제국가 등재 신청서는 EU가 제시한 12개 질문에 대한 답변서 형식으로 구성돼 있다.
주요내용은 ▲원료의약품 GMP에 대한 국내 규정 ▲원료의약품 GMP 실사체계 ▲GMP 조사관 역량 및 실사자원 ▲수출용 제품 관리체계 등이다.
EU는 식약처가 제출한 신청서에 대한 검토 및 현장평가를 통해 우리나라의 면제국가 등재 여부를 결정할 예정이다.
현재 EU가 ‘GMP 서면확인서’ 제출을 면제한 국가는 스위스, 호주, 일본, 미국 등 4개국이며 이스라엘, 싱가포르, 뉴질랜드 등이 신청‧평가 중이다.
특히 식약처는 지난해 7월 의약품실사상호협력기구(PIC/S) 가입 확정으로 PIC/S 가입국 지위를 적극 활용해 짧은 기간 내에 면제국가로 등재 받을 계획이다.
식약처는 우리나라가 EU의 ‘원료의약품 GMP 서면확인서’ 면제국가로 등재되면 서류 간소화에 따른 EU 시장 진입장벽이 완화되는 동시에 PIC/S 가입에 이어 우리나라의 GMP 관리 수준을 다시 한번 국제적으로 공인받아 국내 제약산업의 수출경쟁력 강화가 기대된다고 밝혔다.
icheonsuk@nspna.com, 박천숙 기자(NSP통신)
<저작권자ⓒ 한국의 경제뉴스통신사 NSP통신. 무단전재-재배포 금지.>
![[NSPAD]LG그룹](https://file.nspna.com/ad/T01_lgfuture_3989.gif)
![[NSP7컷]인터넷은행의 혁신적인 배신 [NSP7컷]인터넷은행의 혁신적인 배신](https://file.nspna.com/news/2023/05/30/photo_20230530123951_639759_0.jpg)
![[NSP PHOTO][업앤다운]게임주 하락…썸에이지↑·팡스카이↓](https://file.nspna.com/news/2024/11/26/20241126180853_728773_0.jpg)
![[NSP PHOTO][업앤다운]은행주 하락…BNK금융↑·신한지주↓](https://file.nspna.com/news/2024/11/26/20241126165040_728720_0.jpg)
![[NSP PHOTO]조병규 우리은행장 연임하지 않겠다](https://file.nspna.com/news/2024/11/26/20241126161007_728705_0.jpg)
![[NSP PHOTO][들어보니]해외수주 1, 2위 다툰 삼성물산·현대건설 뒷걸음질..대내외적 원인](https://file.nspna.com/news/2024/11/05/20241105174215_725327_0.png)
![[NSP PHOTO][들어보니]인터넷은행 등 가상계좌 악용 청소년 범죄↑…은행권 작정하고 속이면 심사통과](https://file.nspna.com/news/2024/03/18/20240318130327_688317_0.jpg)
![[NSP PHOTO][들어보니]홍콩ELS 0~100% 배상안에 은행권 차라리 신속히 이사회 설득해야](https://file.nspna.com/news/2024/03/11/20240311140210_687034_0.jpg)
![한화[N06][N06_hanwhagroup_4322] [NSPAD]한화](https://file.nspna.com/ad/N06_hanwhagroup_4322.jpg)
![에쓰오일[N06] [NSPAD]에쓰오일](https://file.nspna.com/ad/N06_soil_4321.jpg)
![농협은행[N06] [NSPAD]농협은행](https://file.nspna.com/ad/N06_nhbank_4306.jpg)
![KB국민카드[N06] [NSPAD]KB국민카드](https://file.nspna.com/ad/N06_KBCARD_4299.jpg)
![토스[N06] [NSPAD]토스](https://file.nspna.com/ad/N06_toss_4292.png)
![KB금융지주[N06] [NSPAD]KB금융지주](https://file.nspna.com/ad/N06_kbjiju_4291.gif)
![종근당[N06][N06_jonggdang_4289] [NSPAD]종근당](https://file.nspna.com/ad/N06_jonggdang_4289.png)
![스마일게이트[N06][N06_smilegate_4287] [NSPAD]스마일게이트](https://file.nspna.com/ad/N06_smilegate_4287.jpg)
![기업은행[N06] [NSPAD]기업은행](https://file.nspna.com/ad/N06_IBKBANK_4285.png)
![하나금융[N06] [NSPAD]하나금융](https://file.nspna.com/ad/N06_hanagroup_4283.jpg)
![한진[N06] [NSPAD]한진](https://file.nspna.com/ad/N06_hanjin_4282.png)
![국민은행[N06] [NSPAD]국민은행](https://file.nspna.com/ad/N06_kbstar_4280.jpg)
![영풍[N06][N06_ypung_4279] [NSPAD]영풍](https://file.nspna.com/ad/N06_ypung_4279.png)
![HD현대[N06][N06_HDHKCHUSUN_4278] [NSPAD]HD현대](https://file.nspna.com/ad/N06_HDHKCHUSUN_4278.jpg)
![삼성SDI[N06] [NSPAD]삼성SDI](https://file.nspna.com/ad/N06_samsungsdi_4277.png)
![CJ올리브영[N06][N06_CJGROUP_4276] [NSPAD]CJ올리브영](https://file.nspna.com/ad/N06_CJGROUP_4276.png)
![위메이드[N06][N06_wemade_4269] [NSPAD]위메이드](https://file.nspna.com/ad/N06_wemade_4269.jpg)
![[NSP PHOTO][금융업계기상도]신한은행 맑음·NH농협은행 흐림](https://file.nspna.com/news/2024/11/22/20241122160608_728217_0.jpg)
![[NSP PHOTO][금융업계기상도]카카오뱅크 맑음·케이뱅크 구름조금](https://file.nspna.com/news/2024/11/15/20241115153449_727092_0.jpg)
![[NSP PHOTO][금융업계기상도]우리은행 비온뒤갬·케이뱅크 흐림](https://file.nspna.com/news/2024/11/08/20241108174637_725979_0.jpg)
![[NSP PHOTO]카카오뱅크 밸류업, 카카오톡과 결합…주주환원율 최대 50% 목표](https://file.nspna.com/news/2024/11/26/photo_20241126115829_728591_0.jpg)
![[NSP PHOTO]우리금융 정조준 금감원…금융권 보여주기 매몰](https://file.nspna.com/news/2024/11/25/photo_20241125144424_728399_0.jpg)
![[NSP PHOTO]대출 한파에 은행앱 사실상 개점휴업…카드론 급전 창구 역할 심각](https://file.nspna.com/news/2024/11/21/photo_20241121121742_727902_0.jpg)
![[NSP PHOTO]해외여행 전성시대…3분기 해외 카드결제 사상 최대치 기록](https://file.nspna.com/news/2024/11/26/photo_20241126160639_728701_0.jpg)
![[NSP PHOTO]트럼프 쇼크 집값 기대↓…경기 전망 1년새 최저](https://file.nspna.com/news/2024/11/26/photo_20241126151623_728683_0.jpg)
![[NSP PHOTO]삼성물산, 카타르 담수복합발전 사업 수주 기대…공사규모 약 4조원·추가수주 전망](https://file.nspna.com/news/2024/11/26/photo_20241126105032_728576_0.jpg)
![[NSP PHOTO]강남 비-사이드 조우진 배우 모든 일터에는 드라마가 있다](https://file.nspna.com/news/2024/11/25/photo_20241125163939_728463_0.jpg)
![[NSP PHOTO]한남4구역 경쟁력…삼성물산 희소성, 현대건설 대단지 구축](https://file.nspna.com/news/2024/11/22/photo_20241122163616_728201_0.png)
![[NSP PHOTO]캠코, 국유부동산 대부·매각 481건…유찰시 저렴한 가격 나와](https://file.nspna.com/news/2024/11/26/photo_20241126142906_728659_0.jpg)
![[NSP PHOTO]비상 걸린 비상금대출…20대, 중·저신용자 몰려 연체율↑](https://file.nspna.com/news/2024/11/20/photo_20241120150609_727701_0.jpg)
![[NSP PHOTO]우정사업본부 우체국쇼핑, 플래티어 그루비 도입](https://file.nspna.com/news/2024/11/19/photo_20241119102559_727411_0.jpg)
![[NSP PHOTO]시프트업 3Q 영업이익 356억원 기록…전년比 120.4%↑·전분기比 21%↓](https://file.nspna.com/news/2024/11/18/photo_20241118161021_727322_0.jpg)
![[NSP PHOTO][타보니]볼보 XC90 B6 AWD, 온·오프로드 자유로운 안전한 SUV](https://file.nspna.com/news/2024/11/25/20241125171334_728470_0.jpg)
![[NSP PHOTO][타보니]혼다 CR-V 하이브리드, 2.0L 직분사 앳킨슨 엔진·E-CVT 변속기 조화로 소음·진동 개선](https://file.nspna.com/news/2024/11/21/20241121160311_727980_0.jpg)
![[NSP PHOTO][타보니]르노 그랑 콜레오스 하이브리드, 가성비·연비 흠잡을 데 없는 SUV](https://file.nspna.com/news/2024/11/19/20241119163226_727533_0.jpg)